【本報訊】一再延遲提供第三期臨床數據的科興生物,昨宣佈已獲內地國家藥監局批准該公司研製的武肺滅活疫苗在內地可以附條件上市。疫苗適用於18歲及以上人士接種,需接種兩次,兩劑相隔14至28日,每次劑量為0.5毫升。
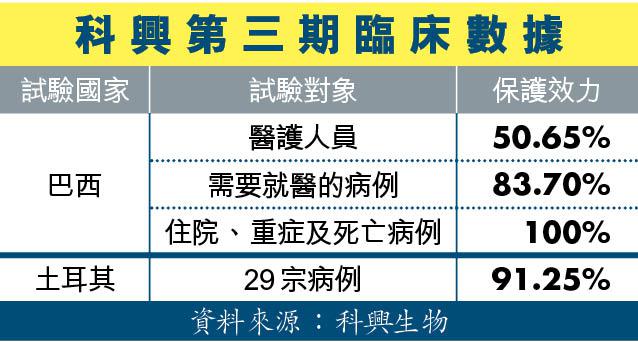
港府宣佈豁免科興於學術期刊刊登的條件後,科興在其官網公佈武肺疫苗第三期臨床研究數據。截至去年12月中,巴西針對18歲以上醫護人員共1.2多萬人試驗,保護效力僅得50.65%。而土耳其的第三期臨床試驗數據基於29宗確診病例的分析,預防病毒的保護效力為91.25%。
科興疫苗供港未有期,政府周五公佈,毋須科興於醫學期刊刊登第三期臨床研究數據,只要求科興提交其向世衞提交的資料作審批。政府未有公佈科興是否已正式提出申請,及以甚麼理由不需於期刊刊登數據。
現時德國BioNtech及莫德納疫苗,均已在國際醫學期刊《新英倫醫學雜誌》發表第三期臨床研究數據。本港預購的英國阿斯利康也已在醫學期刊《刺針》發表第三期數據。

消息人士聲稱,政府沒降低對科興成效、安全及質素的要求,科興需提交的資料與以往一樣,「只不過早咗交」,最終是否科興於醫學期刊發表數據才獲批准使用,視乎專家委員會意見。
有微生物專家指出,不論數據刊登於醫學期刊、由世衞或本地專家評審,最重要是評審過程獨立、客觀,「向醫學期刊交數據刊登,會經過幾個獨立評審者評審,同藥廠冇利益關係,如果有問題,要藥廠修正解答」。在審批過程中能否予人觀感上公平公開很重要。
呼吸系統專科醫生梁子超指出,科興向內地當局提供的數據仍未夠全面,因此只獲批有條件上市。至於科興是否能於本港使用,須視乎科興向本港提供的數據是否全面及真確,而目前仍須等待更多有關科興疫苗用於長者身上的數據。