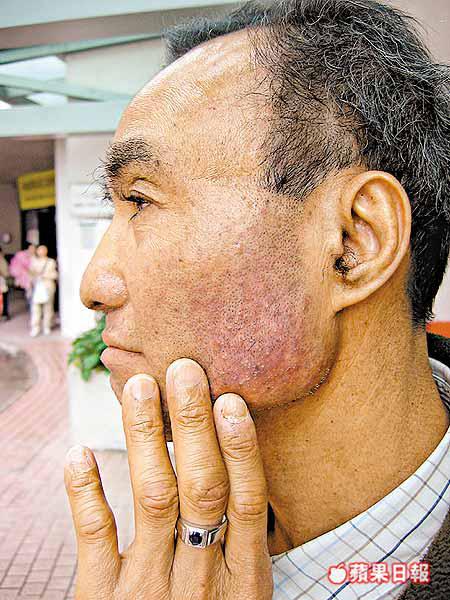
【本報訊】英國發生試藥人士慘變「象人」的驚人事故,揭露藥物臨床測試暗藏巨大風險;原來本港每年有數千人參與各類藥物測試,部份試藥者本着「助人助己」心態,不收分文獻身試藥。藥劑學者指在港進行的試藥計劃過去十年劇增七倍,去年達一百七十五項,相信與國內將會認證本港實驗結果,令完成測試的藥物可能准在內地註冊及銷售有關。 記者:吳淑儀
本港藥物臨床試驗主要由兩所大學及部份大型公立醫院進行,並由醫管局及大學共同設立的倫理委員會監管。提出申請的醫生或藥廠須向衞生署藥劑業及毒藥管理局提供藥物資料、試藥方式、病人同意書及倫理委員會的批文,才會獲發臨床試驗證明書,試藥期內若出現嚴重或超出預期的不良反應,需即停止測試及提交報告,本港幸未有嚴重試藥事故發生。
簽同意書時須小心
近年申請試藥項目急升,九十年代中期每年只有二十項,去年劇升至一百七十五項,升幅逾七倍,估計涉及逾千名試藥者。香港大學李嘉誠醫學院臨床試驗中心名譽副教授崔俊明估計,此趨勢可能因為國家食品藥品監督管理局,正研究認可本港的試藥結果,日後在港完成研究的藥物,可能獲准在內地註冊及銷售。
本港雖未出現過英國「象人」事故,崔俊明卻認為市民應提高試藥認知,包括簽署《知情同意書》前應詳閱條款,了解試驗目的、方式及風險等,若條款已詳列服藥副作用,並註明「可能造成嚴重或致命後果」等字句,出事後能追討賠償的機會便較低。
研發新藥需逾15年
崔俊明解釋,新藥研發期至少十五至二十年,過程由化學實驗進展至動物及人體研究(見表),他說:「新藥先以哺乳類動物作測試,評估安全劑量及副作用後,就會進行四階段人體臨床試驗。」
有進行首階段人體測試的中文大學臨床試驗中心,總監徐仲金英表示,第一階段測試,旨在找出藥物在人體內停留多久會有影響,用藥份量一定很低,確保不會對人體造成毒性。
現時中大約有一百項臨床研究,當中腫瘤藥約三十種,另有糖尿、膽固醇及風濕藥等研究。徐仲金英指出,腫瘤新藥主要由沒有其他療法的癌症病人測試,「新藥可以為病人帶來一線希望,就算無幫助亦唔會加速腫瘤惡化,只係有啲副作用可能令病人唔舒服。」
不應抱有搵錢心態
港大則主要進行第三或第四階段測試,即監察新藥推出市場前後的治療效果,試藥者為真正病患。
港大教學醫院瑪麗醫院藥劑部臨床試驗藥劑師陳碧琪表示,部份試藥病人會因嚴重副作用或病情轉變而停藥,但有關數據有助改善藥物品質。
藥劑界認為市民不應抱「搵錢」心態參與試藥,目前大部份試藥者均不收分文,小部份可獲得數百至數千元的生活費或車馬費津貼。
鑑於發生英國試藥事故,香港醫院藥劑師協會印發「臨床試驗簡介」單張在醫院派發,相關網址: http://www.derchk.org,增加市民對試藥計劃的認識。